알츠하이머병의 초기 진단과 증상을 완화하는 조기 개입에 대해 의료계는 대체로 일치된 견해를 보인다.
기억력 저하 증상이 없더라도 아밀로이드 베타 단백질의 침적이 나타나면 치료를 시작해야 한다는 것이다.
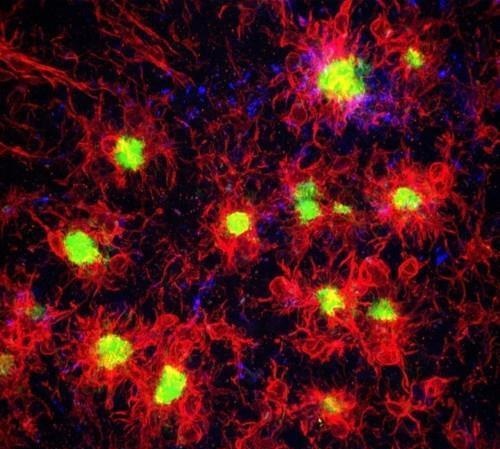
비정상으로 접힌(misfolded) 아밀로이드 베타 단백질이 뭉쳐 플라크(신경반) 형태로 뇌신경에 쌓이는 게 알츠하이머병의 대표적 전조다.
이런 비정상 아밀로이드가 뇌에 침적하기까지의 연쇄 반응이 여태껏 생각했던 것보다 훨씬 이른 시점에 시작된다는 연구 결과가 나왔다.
과학자들은 이 연쇄 반응을 촉발하는 '응집의 씨앗'(seeds of aggregation)을 찾아냈고, 이 씨앗을 제거하면 먼 훗날의 아밀로이드 침적이 대폭 완화된다는 걸 동물 실험에서 확인했다.
이 연구를 수행한 독일 튀빙겐대의 마티아스 유커 신경과학 교수는 알츠하이머병의 유사 프라이온(prion-like) 기제 연구로 유명한 알츠하이머병 전문가다.
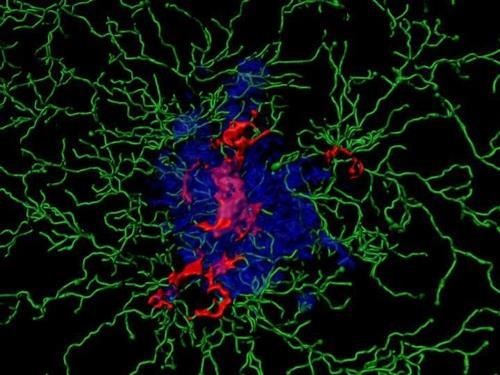
11월 18일 미국 과학진흥협회 사이트(www.eurekalert.org)에 올라온 논문 개요 등에 따르면 이번에 발견된 아밀로이드 플라크 씨앗은 현재 기술로 생화학적 검출이 어려울 정도로 미세하다.
하지만 인체에서 그 실체를 확인하게 된다면 알츠하이머병 진행을 원인 단계에서 차단하는 치료법 개발로 이어질 것으로 기대를 모은다.
연구팀은 변형 베타 아밀로이드 단백질을 표적으로 작용하게 디자인된 6종의 항체를 대상으로 이 씨앗을 탐지해 제거하는 능력이 있는지 테스트했다.
이 시험에서 유일하게 효능이 확인된 게 단일 클론 항체인 아두카누맙(aducanumab)이다.
아밀로이드 침적이 처음 관찰되기 직전 5일 간 아두카누맙을 투여한 생쥐는 죽을 때까지 뇌에 쌓인 아밀로이드가 대체적인 예상치의 절반에 그쳤다.
유커 교수는 "이 항체 투여로 아밀로이드 씨앗은 확실히 제거됐는데 상당한 시간이 지난 뒤 새로운 씨앗이 생긴 것 같다"라면서 "항체 치료 6개월 후 생쥐의 뇌 손상은 절반으로 줄었다"라고 설명했다.
연구팀은 이 씨앗이 아밀로이드 침적의 연쇄 반응을 촉발한다는 것만 확인했을 뿐 아직 이 씨앗이 어떻게 생겼는지도 모른다.
같은 맥락에서 이 씨앗은 인간의 CJD(크로이츠펠트 야콥병), 소의 BSE(일명 광우병) 등을 일으키는 프라이온 단백질과 비슷한 속성을 가졌다고 과학자들은 평가한다.
그 밖에도 풀어야 할 의문점은 많다. 실례로 아밀로이드 씨앗을 탐지하는 아두카누맙 항체가 나중에 생기는 아밀로이드 사슬에는 전혀 반응하지 않는다.
연구팀은 아두카누맙 항체를 일종의 낚싯바늘(fishhook)로 활용해, 아밀로이드 씨앗을 분리하고 그 특성도 상세히 밝혀내기를 희망한다.
유커 교수는 "알츠하이머병의 초기 씨앗에 초점을 맞춰 생물 표지를 확인할 필요가 있다"라면서 "다른 유형의 알츠하이머 씨앗에 작용하는 항체를 더 많이 발굴하면, 연쇄 반응 촉발 과정과 치료법 등을 이해하는 데 도움이 될 것"이라고 강조했다.
한편 마티아스 유커 신경과학 교수 연구팀의 관련 논문은 최근 '네이처 신경과학'(Nature Neuroscience)에 게재됐다.



